Из примерно 17 тысяч существующих сейчас ускорителей лишь около сотни используются в научных целях. Остальные — это компактные низкоэнергетические ускорители, используемые в медицине.
Например, пучки протонов определенной энергии позволяют с миллиметровой точностью выжигать глубокие опухоли без существенного воздействия на остальные ткани. При торможении в веществе протоны выделяют основную часть своей энергии на последних миллиметрах пути. Зная глубину залегания опухоли, можно так подобрать энергию пучка, чтобы эти последние миллиметры как раз попали внутрь опухоли.
Другое применение ускорителей в онкологии — нейтронная борозахватная терапия. В организм пациента вводится фармпрепарат с изотопом бора-10, который сильнее накапливается в клетках опухоли, чем в здоровых клетках. Ядра бора-10 обладают очень высокой вероятностью захватывать пролетающие мимо тепловые нейтроны, поэтому если пациента облучить нейтронным пучком, то нейтроны будут поглощаться преимущественно клетками опухоли и разрушать их. В этом состоит отличие этой методики от протонной терапии — ведь протоны выделают свою энергию одинаково и в больных, и здоровых клетках. Поэтому с помощью нейтронной терапии можно эффективно воздействовать на злокачественные образования, которые не локализованы в виде отдельной опухоли, а распределены по всему пораженному органу. Нейтронный ускоритель, призванный сделать эту терапию доступной и эффективной, разрабатывается сейчас в новосибирском Институте ядерной физики.
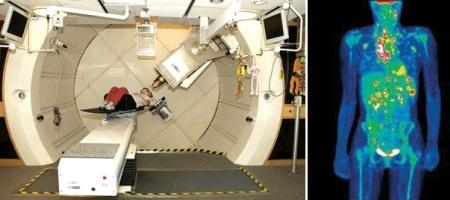
Ускорители применяют и для создания прямо в медицинском центре короткоживущих ядер-маркеров с периодом полураспада порядка часа. Сразу после синтеза они вводятся в организм, оседают в тканях и вскоре распадаются. Высокочувствительные детекторы регистрируют продукты распада и дают четкое изображение тканей. Благодаря сверхнизкой концентрации радиоизотопов такая диагностика заболеваний довольно безопасна. Основанная на этой идее позитронно-эмиссионная томография используется сейчас во многих клиниках мира.
Наконец, многие электронные ускорители работают как источники синхротронного излучения — яркого и узконаправленного рентгеновского луча, которым «светят» электроны в магнитном поле. Такой луч используется как для диагностики заболеваний (например, для получения четких снимков сети мелких кровеносных сосудов), так и для терапевтического воздействия. Кстати, для детектирования рентгеновских лучей сейчас широко используют не пленки, а цифровые рентгенографические установки. Это потомки детекторов высокоэнергетических фотонов, применявшихся в ускорительных экспериментах. Их чувствительность во много раз выше, чем у пленки, и, кроме того, они обладают очень высоким пространственным разрешением и совершенно недостижимым на обычных пленках количеством градаций яркости. Благодаря этому на одном и том же снимке, подобрав правильный контраст, можно изучать структуру и костей, и мягких тканей.
- Зачем нужен ускоритель
- Единицы измерения расстояний, энергий и масс
- Краткая история ускорителей
- Как работает ускоритель
- Основные компоненты детектора
- Как на ускорителе изучают свойства частиц
- Природные ускорители
- Применение ускорителей и детекторов в медицине
Вернуться к интерактивной модели

