Термодинамические свойства газа зависят от средней скорости движения атомов или молекул, из которых он состоит.
Атомы или молекулы, из которых состоит газ, свободно движутся на значительном удалении друг от друга и взаимодействуют только при соударениях друг с другом (далее, чтобы не повторяться, я буду упоминать только «молекулы», подразумевая под этим «молекулы или атомы»). Поэтому молекула движется прямолинейно лишь в промежутках между соударениями, меняя направление движения после каждого такого взаимодействия с другой молекулой. Средняя длина прямолинейного отрезка движения молекулы газа называется усредненным свободным путем. Чем выше плотность газа (и, следовательно, меньше среднее расстояние между молекулами), тем короче средний свободный путь между столкновениями.
Во второй половине XIX века столь простая внешне картина атомно-молекулярной структуры газов усилиями ряда физиков-теоретиков развилась в мощную и достаточно универсальную теорию. В основу новой теории легла идея о связи измеримых макроскопических показателей состояния газа (температуры, давления и объема) с микроскопическими характеристиками — числом, массой и скоростью движения молекул. Поскольку молекулы постоянно находятся в движении и, как следствие, обладают кинетической энергией, эта теория и получила название молекулярно-кинетической теории газов.
Возьмем, к примеру, давление. В любой момент времени молекулы ударяются о стенки сосуда и при каждом ударе передают им определенный импульс силы, который сам по себе крайне мал, однако суммарное воздействие миллионов молекул производит к значительному силовому воздействию на стенки, которое и воспринимается нами как давление. Например, накачивая автомобильное колесо, вы перегоняете молекулы атмосферного воздуха внутрь замкнутого объема шины дополнительно к числу молекул, уже находящихся внутри нее; в результате концентрация молекул внутри шины оказывается выше, чем снаружи, они чаще ударяются о стенки, давление внутри шины оказывается выше атмосферного, и шина становится накачанной и упругой.
Смысл теории состоит в том, что по среднему свободному пути молекул мы можем рассчитать частоту их столкновений со стенками сосуда. То есть, располагая информацией о скорости движения молекул, можно рассчитать характеристики газа, поддающиеся непосредственному измерению. Иными словами, молекулярно-кинетическая теория дает нам прямую связь между миром молекул и атомов и осязаемым макромиром.
То же самое касается и понимания температуры в рамках этой теории. Чем выше температура, тем больше средняя скорость молекул газа. Эта взаимосвязь описывается следующим уравнением:
1/2mv2 = kT
где m — масса одной молекулы газа, v — средняя скорость теплового движения молекул, Т — температура газа (в Кельвинах), k — постоянная Больцмана. Основное уравнение молекулярно-кинетической теории определяет прямую связь между молекулярными характеристиками газа (слева) и измеримыми макроскопическими характеристиками (справа). Температура газа прямо пропорциональна квадрату средней скорости движения молекул.
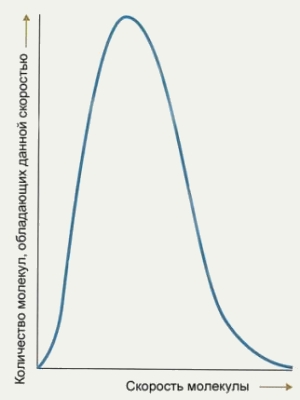
Молекулярно-кинетическая теория также дает достаточно определенный ответ на вопрос об отклонениях скоростей отдельных молекул от среднего значения. Каждое столкновение между молекулами газа приводит к перераспределению энергии между ними: слишком быстрые молекулы замедляются, слишком медленные — ускоряются, что и приводит к усреднению. В любой момент в газе происходят несчетные миллионы таких столкновений. Тем не менее выяснилось, что при заданной температуре газа, находящегося в стабильном состоянии, среднее число молекул, обладающих определенной скоростью v или энергией Е, не меняется. Происходит это потому, что со статистической точки зрения вероятность того, что молекула с энергией Е изменит свою энергию и перейдет в близкое энергетическое состояние, равна вероятности того, что другая молекула, наоборот, перейдет в состояние с энергией Е. Таким образом, хотя каждая отдельно взятая молекула обладает энергией Е лишь эпизодически, среднее число молекул с энергией Е остается неизменным. (Аналогичную ситуацию мы наблюдаем в человеческом обществе. Никто не остается семнадцатилетним дольше одного года — и слава Богу! — однако в среднем процент семнадцатилетних в стабильном человеческом сообществе остается практически неизменным.)
Эта идея усредненного распределения молекул по скоростям и ее строгая формулировка принадлежит Джеймсу Кларку Максвеллу — этому же выдающемуся теоретику принадлежит и строгое описание электромагнитных полей (см. Уравнения Максвелла). Именно он вывел распределение молекул по скоростям при заданной температуре (см. рисунок). Больше всего молекул пребывают в энергетическом состоянии, соответствующем пику распределения Максвелла и средней скорости, однако, фактически, скорости молекул варьируются в достаточно больших пределах.
См. также:
1798 Механическая теория теплоты
XIX век Теплообмен
1801 Закон Дальтона
1811 Закон Авогадро
1829 Закон Грэма
1834 Уравнение Клапейрона—Клаузиуса
1877 Постоянная Больцмана